Pengaruh Kalor Terhadap Suhu dan Wujud Zat, Rumus, Grafik, Contoh Soal dan Pembahasan
https://www.fisikabc.com/2018/04/pengaruh-kalor-terhadap-suhu-dan-wujud-zat.html?m=0
Daftar Materi Fisika
Advertisement
Baca Juga:
Setiap ada perbedaan suhu antara dua sistem, maka akan terjadi perpindahan kalor. Kalor mengalir dari sistem bersuhu tinggi ke sistem yang bersuhu lebih rendah. Apa sajakah pengaruh kalor terhadap suatu sistem atau benda?
1. Kalor dapat Mengubah Suhu Benda
Kalor merupakan salah satu bentuk energi, sehingga dapat berpindah dari satu sistem ke sistem yang lain karena adanya perbedaan suhu. Sebaliknya, setiap ada perbedaan suhu antara dua sistem maka akan terjadi perpindahan kalor. Sebagai contoh, es yang dimasukkan ke dalam gelas berisi air panas, maka es akan mencair dan air menjadi dingin. Karena ada perbedaan suhu antara es dan air maka air panas melepaskan sebagian kalornya sehingga suhunya turun dan es menerima kalor sehingga suhunya naik (mencair).
Pernahkah kalian mengamati sebuah besi yang diberi kalor, misalnya dibakar? Tentu kalian sering mengamatinya. Besi tersebut akan menjadi lebih panas. Lebih panas ini berarti suhunya naik. Contoh ini membuktikan bahwa kalor dapat mengubah suhu zat. Pengaruh ini banyak penggunaannya dalam kehidupan sehari-hari. Contohnya memasak air, memanasi besi untuk melubangi kayu atau karet dan memanaskan benda waktu pagi pada terik matahari.
Kalor yang dibutuhkan untuk menaikkan suhu zat ini dipengaruhi oleh massa benda m, kenaikan suhu Δt dan jenis zat. Jenis zat diukur dengan besaran yang dinamakan kalor jenis dan disimbulkan c. Kalor jenis adalah banyaknya kalor yang diserap zat bermassa 1 g untuk menaikkan suhu sebesar 1oC. Hubungan besaran-besaran ini dapat dituliskan sebagai berikut.
Q = mc∆T ………. Pers. (1)
|
Keterangan:
Q = kalor yang diserap benda (kal)
m = massa benda (g)
c = kalor jenis (kal/goC)
∆T = kenaikan suhu (oC)
Perkalian massa dan kalor jenisnya disebut dengan kapasitas kalor yang dilambang dengan C dan dirumuskan sebagai berkut.
C = mc ………. Pers. (2)
|
Keterangan:
C = kapasitas kalor (kal/oC)
m = massa benda (g)
c = kalor jenis (kal/goC)
Poin Penting!
|
□ Kalor merupakan bentuk energi yaitu energi panas. Karena bentuk energi maka dalam sistem SI, kalor memiliki satuan joule. Kesetaraannya:
1 kal = 4,2 joule atau
1 joule = 0,24 kal
□ Berarti dalam sistem SI, kalor jenis dapat didefinisikan sebagai kalor yang dibutuhkan 1 kg benda agar suhunya naik 1K.
|
Contoh Soal 1:
Batang logam bermassa 2 kg memiliki suhu 25oC. Untuk menaikkan suhunya menjadi 75oC dibutuhkan kalor sebesar 5 × 104 kal. Jika suhunya dinaikkan menjadi 125oC maka berapakah kalor yang dibutuhkan?
Penyelesaian:
Diketahui:
m = 2 kg = 2.000 g
∆T1 = 75oC – 25oC = 50oC → Q1 = 5 × 104 kal
∆T2 = 125oC – 25oC = 100oC → Q2 = ?
Kalor jenis benda dapat ditentukan dari keadaan pertama.
Q1 = mc∆T1
5 × 104 = 2.000 × c × 50
5 × 104 = 100.000 × c
c = 5 × 104/105
c = 5 × 10-1
c = 0,5 kal/goC
berarti kalor yang dibutuhkan untuk menaikkan suhu ∆T2 sebesar:
Q2 = mc∆T2
Q2 = 2.000 × 0,5 × 100
Q2 = 100.000
Q2 = 105 kal
Konsep kesebandingan
Kalor untuk menaikkan suhu sebanding dengan kenaikan suhunya.
Q ~ ∆T
Berarti dapat diperoleh:
Q2
|
=
|
∆T2
|
Q1
|
∆T1
|
Q2
|
=
|
100
|
× 5 × 104 = 105 kal
|
50
|
2. Kalor dapat Mengubah Wujud Zat
Kalor yang diberikan pada zat dapat mengubah wujud zat tersebut. Perubahan wujud yang terjadi ditunjukkan oleh Gambar di bawah ini. Cobalah mengingat kembali pelajaran SMP, dan carilah contoh dalam kehidupan sehari-hari yang menunjukkan perubahan wujud zat karena dipengaruhi kalor.
Kalian pasti sudah mengetahui bahwa wujud zat ada tiga yaitu padat, cair dan gas. Pernahkah kalian melihat es yang mencair atau air yang sedang menguap? Ternyata perubahan wujud zat itu membutuhkan kalor. Banyaknya kalor untuk mengubah wujud 1 g zat dinamakan kalor laten. Kalor laten ada dua jenis,
■ Pertama: kalor lebur untuk mengubah dari padat ke cair. Kalor lebur zat sama dengan kalor bekunya.
■ Kedua: kalor uap yaitu kalor untuk mengubah dari cair menjadi gas. Kalor uap zat sama dengan kalor embun. Kalor laten ini disimbulkan L.
Dari penjelasan di atas maka dapat ditentukan kalor yang dibutuhkan zat bermassa m untuk mengubah wujudnya yaitu sebagai berikut:
Q = mL ………. Pers. (3)
|
Keterangan:
Q = kalor (kal)
m = massa benda (g)
L = kalor laten (kal/g)
Contoh Soal 2:
Di atas piring terdapat 100 g es bersuhu 0OC. Kalor lebur es diketahui sebesar 80 kal/g. Jika pada es tersebut diberikan kalor sebesar 6000 kal maka berapa persenkah es yang sudah melebur?
Penyelesaian:
m0 = 100 g
L = 80 kal/g
Q = 6000 kal
Massa es yang melebur dapat ditentukan sebagai berikut.
Q = mL
6000 = m × 80
m = 6000/80
m = 75 g
Massa es yang melebur adalah 75 g berarti prosentasenya sebesar:
m
|
=
|
75
|
× 100% = 75%
|
m0
|
100
|
Poin Penting!
|
□ Sesuai dengan kalor jenis, dalam sistem SI, kalor laten dapat didefinisikan sebagai kalor yang dibutuhkan untuk mengubah wujud 1 kg zat.
□ Kalor jenis air: 1 kal/goC = 4200 joule/kgK
□ Kalor lebur es: 80 kal/g = 3,36 × 105 J/kg
|
Perubahan Suhu dan Wujud Zat
Baru saja kalian telah belajar bahwa kalor dapat merubah suhu atau wujud zat. Berarti jika suatu benda diberi kalor yang cukup dapat terjadi kedua perubahan itu. Perubahan benda ini dapat digambarkan dengan bantuan grafik Q-T. Contoh perubahan ini dapat digunakan perubahan air dari bentuk padat (es) hingga bentuk gas (uap). Grafik Q-T nya dapat dilihat pada gambar di bawah ini.
Pada gambar grafik di atas, terlihat bahwa air dapat mengalami tiga kali perubahan suhu dan dua kali perubahan wujud. Pada saat mencair (Q2) dan menguap (Q4) membutuhkan kalor perubahan wujud Q = mL. Sedangkan kalor Q1, Q3 dan Q5 merupakan kalor perubahan suhu Q = mcΔT. Untuk lebih memahami perubahan zat karena pengaruh kalor dapat kalian cermati contoh berikut.
Contoh Soal 1:
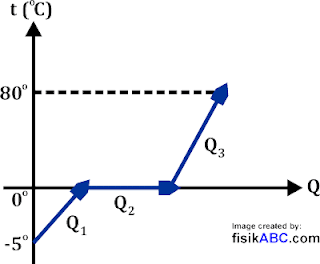
20 g es bersuhu –5oC dan tekanan 1 atm diberi kalor hingga menjadi air bersuhu 80oC. Kalor jenis air 1 kal/goC, kalor jenis es 0,5 kal/goC dan kalor lebur es 80 kal/g. Berapakah kalor yang diberikan pada es tersebut?
Penyelesaian:
Pada tekanan 1 atm air mencair pada suhu 0oC dan menguap pada suhu 100oC. Berarti untuk menghitung kalornya dapat dibuatkan grafik Q-t seperti pada gambar berikut ini.
Kalor yang dibutuhkan sebesar:
Q = Q1 + Q2 + Q3
Q = mscsΔTs + mL + macaΔTa
Keterangan:
ms = massa es
cs = kalor jenis es
ΔTs = perubahan suhu es
|
ma = massa air
ca = kalor jenis air
ΔTa = perubahan suhu air
|
Q = (10 × 0,5 × 5) + (20 × 80) + (20 × 1 × 80o)
Q = 50 + 1600 + 1600
Q = 3250 kal